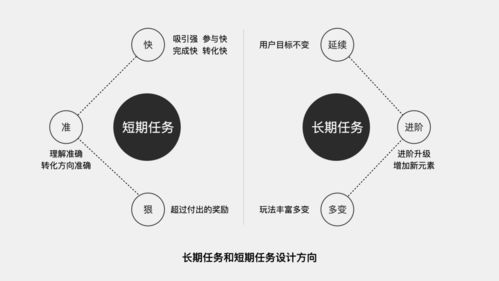
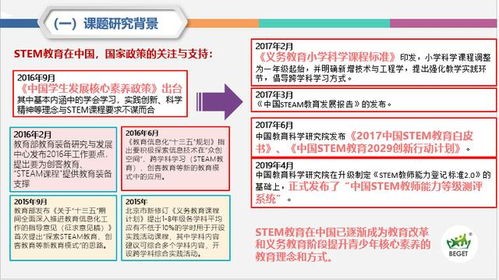
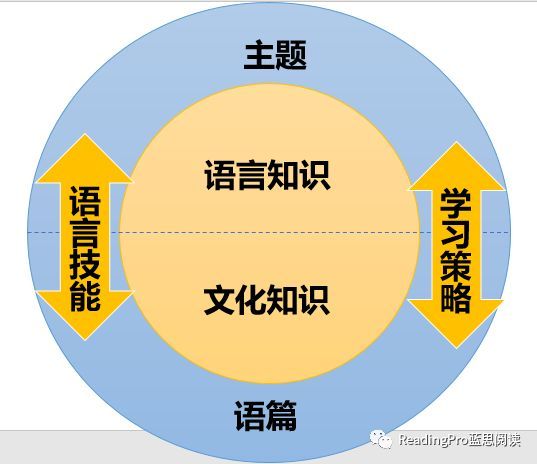
高中化学必修一知识点总结与学习建议
高中化学必修一作为化学学习的入门阶段,涵盖了化学的核心基础概念。这些知识点不仅是后续学习的重要基石,也是培养学生科学思维的关键。以下是必修一重点内容的归纳总结,以及一些学习建议,帮助学生更好地掌握这些知识。
一、物质的组成、性质与分类
化学的基础是对物质的认识,理解物质的组成、性质及分类是化学入门的第一步。
1. 物质的组成
- 物质由元素组成,元素由原子构成。
- 原子包括质子(带正电)、中子(不带电)和电子(带负电)。
- 掌握核外电子排布规律,理解同位素的概念及其应用。
2. 物质的性质
- 物理性质:颜色、气味、密度、熔点、沸点等。
- 化学性质:可燃性、氧化性、还原性等。
- 区分物理变化和化学变化,掌握通过实验判断物质性质的方法。
3. 物质的分类
- 按组成分类:单质、化合物、混合物。
- 按导电性分类:金属、非金属。
- 按状态分类:固体、液体、气体。
学生需重点掌握这些分类方法,理解不同类别物质之间的区别与联系。
二、物质的量与摩尔
物质的量是化学中的核心概念之一,用于表示微观粒子的数量。
1. 摩尔的定义
- 1摩尔物质包含6.02×10²³个微观粒子(阿伏伽德罗常数)。
2. 摩尔质量
- 摩尔质量是指每摩尔物质的质量,单位为g/mol。
- 学会根据化学式计算摩尔质量,例如H₂O的摩尔质量为18g/mol。
3. 物质的量的计算
- 公式:\( n = \frac{m}{M} \)
- 其中,\( n \)为物质的量,\( m \)为物质的质量,\( M \)为摩尔质量。
通过练习这些计算,学生能够更好地理解化学反应中的物质量关系,为化学方程式的学习打下基础。
三、化学方程式与化学反应
化学反应是化学学习的核心,化学方程式是描述化学反应的工具。
1. 化学方程式的书写
- 用化学符号和化学式表示化学反应,格式为:反应物→生成物。
- 遵守质量守恒定律,确保反应前后原子数目相等。
2. 化学方程式的配平
- 采用“最小公倍数法”配平,从原子最多的元素开始。
3. 常见的化学反应类型
- 化合反应:A + B → AB
- 分解反应:AB → A + B
- 置换反应:A + BC → AC + B
- 复分解反应:AB + CD → AD + CB
学生需熟练掌握这些反应类型及其特点。
四、离子反应与溶液
离子反应和溶液化学是化学学习的重要内容,尤其是酸碱中和反应和电解质的概念。
1. 离子反应
- 电解质溶解于水后发生电离,生成自由移动的离子。
- 常见的离子反应包括酸碱中和反应和沉淀反应。
2. 电解质和非电解质
- 电解质:在水溶液中能导电的物质(如酸、碱、盐)。
- 非电解质:在水溶液中不能导电的物质(如蔗糖、酒精)。
- 区分强电解质(完全电离)和弱电解质(部分电离)。
3. 溶液中的浓度计算
- 常见浓度单位:质量分数、摩尔浓度等。
- 熟练掌握浓度单位的转换及计算。
学习建议
- 理解概念:化学是一门概念性很强的学科,学生需注重对基本概念的理解,而非死记硬背。
- 多做实验:通过实验观察物质的性质和反应现象,加深对理论知识的理解。
- 练习计算:物质的量、摩尔质量、浓度计算等内容需要反复练习,掌握计算方法。
- 总结归纳:定期对知识点进行归纳总结,形成知识网络,便于记忆和应用。
- 及时复习:化学知识点之间联系紧密,及时复习可以避免知识遗忘。
高中化学必修一的知识点虽然基础,但非常重要。通过系统学习和反复练习,学生可以打下坚实的化学基础,为后续学习做好准备。
声明:本站资源来自会员发布以及互联网公开收集,不代表本站立场,仅限学习交流使用,请遵循相关法律法规,请在下载后24小时内删除。 如有侵权争议、不妥之处请联系本站删除处理! 请用户仔细辨认内容的真实性,避免上当受骗!