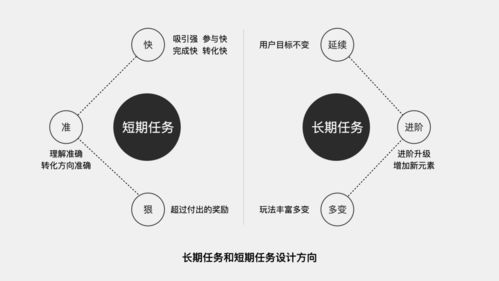
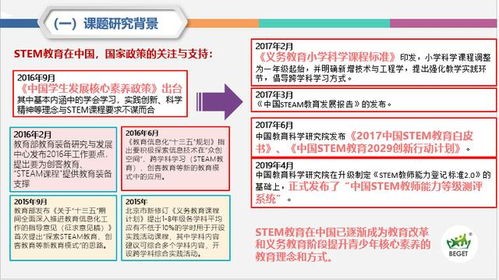
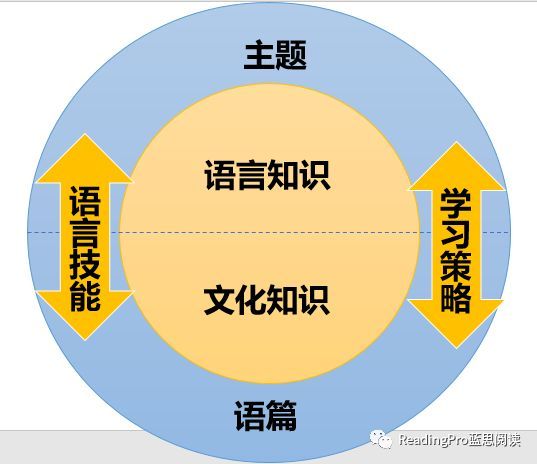
高中化学必修一是化学学习的基础,涵盖了物质的组成与结构、化学反应、物质的量、化学方程式、常见反应类型、氧化还原反应、离子反应以及化学平衡等重要内容。以下是对这些知识点的详细总结,帮助你更好地掌握和理解这些内容。
一、物质的组成与结构
1. 物质的分类
– **纯净物和混合物**:纯净物只有一种成分,比如氧气(O₂)、水(H₂O);混合物由两种或两种以上物质混合组成,比如空气、食盐水。
– **单质和化合物**:纯净物中,单质是由同种元素组成的物质(如氧气),而化合物则是由不同元素组成的物质(如水)。
2. 元素和原子
– **元素**:化学中指具有相同核电荷数(即质子数)的原子的种类,比如氢元素(H)、氧元素(O)。
– **原子结构**:原子由原子核(内含质子和中子)和电子构成,电子在核外运动。质子带正电,电子带负电,中子不带电。
3. 相对原子质量
– **定义**:以碳-12原子质量的1/12为基准,其他元素的原子质量相对于它的质量。单位没有实质质量,但便于比较不同元素的原子质量。
4. 分子与离子
– **分子**:由两个或多个原子结合形成的中性微粒,具有物质化学性质的最小单位,如水分子(H₂O)、氧气分子(O₂)。
– **离子**:带电荷的原子或原子团。正离子(失去电子)和负离子(获得电子)相互结合形成离子化合物。
二、化学反应中的质量守恒定律
– **定义**:化学反应中,反应物的质量总和等于生成物的质量总和,反应过程中,原子的种类和数量保持不变。
– **应用**:在进行化学方程式配平时,依据质量守恒定律确保化学反应前后原子的种类和数量相同。实际操作中,质量守恒定律是实验设计与反应预测的基础。
三、物质的量
1. 摩尔的定义
– **摩尔**:摩尔是物质的量的基本单位,1摩尔指含有6.02×10²³个微粒(如原子、分子、离子)的物质。
– **阿伏伽德罗常数**:6.02×10²³是阿伏伽德罗常数,代表1摩尔任何物质中微粒的数目。
2. 摩尔质量
– **定义**:单位物质的量所对应的质量称为摩尔质量,单位为g/mol。摩尔质量数值上等于相对分子质量。例如,水(H₂O)的摩尔质量为18g/mol,因为其相对分子质量为18。
3. 气体摩尔体积
– **定义**:在标准状况下(0℃,101kPa),1摩尔任何气体的体积约为22.4升。这是一个常用的经验值,有助于处理气体反应中的体积问题。
四、化学方程式
1. 书写与配平
– **化学方程式**:用化学符号和化学式表示化学反应的表达式。书写时,需要确保反应物和生成物的元素符号正确,同时还需遵循质量守恒定律配平。
2. 反应物和生成物
– **反应物**:参与反应的物质,生成物是反应后生成的新物质。书写化学方程式时,反应物位于方程式左侧,生成物位于右侧,中间用箭头连接。
3. 能量变化
– **放热反应**:释放热量(如燃烧反应)。
– **吸热反应**:需要吸收热量(如一些分解反应)。
五、常见的化学反应类型
1. 化合反应
– **定义**:两个或多个物质反应生成一种新物质的反应,称为化合反应。比如,碳和氧气反应生成二氧化碳(C + O₂ → CO₂)。
– **典型特征**:生成物的物质比反应物少。
2. 分解反应
– **定义**:一种化合物分解成两种或多种物质的反应称为分解反应。比如,水在电解时分解成氢气和氧气(2H₂O → 2H₂ + O₂)。
– **特点**:反应物为单一化合物,生成物为多种物质。
3. 置换反应
– **定义**:一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,称为置换反应。比如,锌与盐酸反应生成氢气和氯化锌(Zn + 2HCl → ZnCl₂ + H₂)。
– **特点**:金属置换非金属或氢,或非金属置换金属。
4. 复分解反应
– **定义**:两种化合物相互交换成分生成两种新的化合物的反应,称为复分解反应。比如,硫酸钠与氯化钡溶液反应生成硫酸钡沉淀(Na₂SO₄ + BaCl₂ → 2NaCl + BaSO₄↓)。
– **特点**:两种化合物参与反应,生成新化合物。
六、氧化还原反应
1. 概念
– **氧化反应**:元素得氧或失去电子的过程。
– **还原反应**:元素失去氧或得到电子的过程。
– **氧化还原反应**:同时发生氧化和还原的反应,伴随电子转移。
2. 氧化剂与还原剂
– **氧化剂**:能够使其他物质氧化、自己被还原的物质。例如,氧气在大多数反应中作为氧化剂。
– **还原剂**:能够使其他物质还原、自己被氧化的物质。如氢气在某些反应中作为还原剂。
七、离子反应
1. 电解质与非电解质
– **电解质**:溶于水或熔化时能导电的物质,如盐酸、硫酸、氯化钠等。
– **非电解质**:溶于水或熔化时不导电的物质,如糖、酒精等。
2. 电离与离子反应
– **电离**:电解质在水中溶解时,电离成自由移动的离子,这个过程称为电离。例如,氯化钠在水中电离为Na⁺和Cl⁻。
– **离子反应**:通过离子间相互作用发生的化学反应,通常发生在水溶液中。
3. 常见离子方程式
– **例子**:氯化钡溶液与硫酸钠溶液反应生成硫酸钡沉淀的反应,离子方程式为:Ba²⁺ + SO₄²⁻ → BaSO₄↓。
八、化学平衡
1. 化学平衡状态
– **定义**:在一定条件下,化学反应达到一定程度后,反应速率相等,生成物和反应物的浓度保持不变,这种状态称为化学平衡状态。
2. 平衡移动
– **定义**:在外界条件(如温度、压力、浓度)变化时,化学平衡状态会发生移动,称为平衡移动。利用勒夏特列原理可以预测平衡的移动方向。
通过对这些知识点的总结,相信你对高中化学必修一的内容有了更加清晰的理解。这些基础知识在日后的化学学习中至关重要,打好基础才能为后续的化学挑战做好准备。