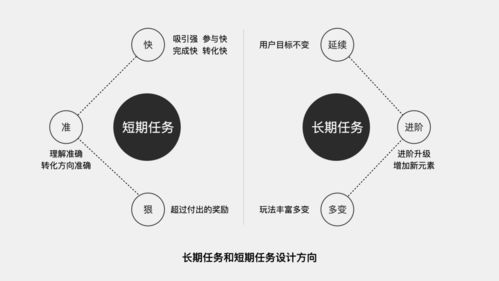
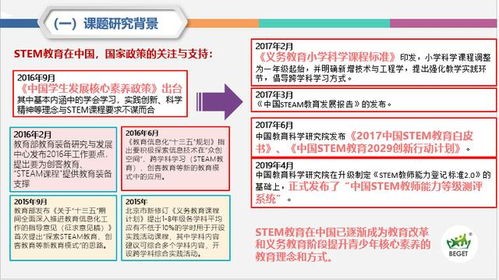
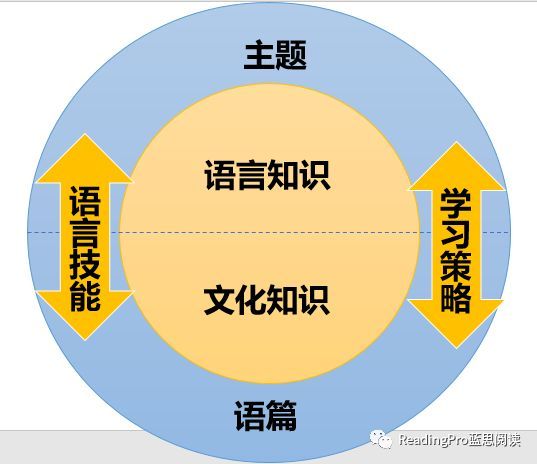
化学方程式:化学世界的语言
化学方程式是描述化学反应的核心工具,它们不仅揭示了反应物与生成物之间的关系,还帮助我们理解反应的本质和规律。掌握化学方程式是学好高中化学的关键,以下是关于化学方程式的基础知识、学习方法、常见反应类型以及应对常见问题的总结与建议。
1. 化学方程式的基础知识
- 反应物与生成物:化学方程式的左边是反应物,右边是生成物。例如,水的分解反应中,反应物是水(H₂O),生成物是氢气(H₂)和氧气(O₂)。
- 化学计量:化学方程式必须遵循质量守恒定律,反应前后原子的种类和数目必须相等。例如,水的分解反应配平后为:2H₂O → 2H₂ + O₂。
- 符号与状态表示:化学方程式中常用符号表示物质的状态,如“(s)”表示固体,“(l)”表示液体,“(g)”表示气体,“(aq)”表示水溶液。
2. 如何有效学习化学方程式
- 从简单反应开始:先掌握基础反应,如燃烧反应、置换反应等,逐步建立自信。
- 理解反应本质:每个化学反应都有其特定的原理,理解这些原理有助于更快掌握方程式。
- 练习配平方程式:配平是化学方程式学习的核心技能,建议从简单到复杂逐步练习。
- 运用视觉化工具:通过化学模拟软件或视频,直观理解反应过程,提升学习兴趣。
3. 高中常见的化学方程式及其应用
- 氧化还原反应:如铁生锈的反应:4Fe + 3O₂ → 2Fe₂O₃。这类反应在金属性质和电化学中非常重要。
- 中和反应:如氢氧化钠与盐酸反应:NaOH + HCl → NaCl + H₂O。中和反应在理论和实际生活中都有广泛应用。
- 沉淀反应:如硫酸钡的生成:BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl。沉淀反应在实验室和医学影像中都有重要应用。
4. 应对化学方程式常见问题
- 记忆困难:将化学方程式与实际生活或实验现象联系起来,使用记忆卡片或反复抄写加深记忆。
- 配平困难:尝试“奇数法则”或“最小公倍数法”快速找到反应物和生成物的比例。
- 反应规律不清楚:通过多做题、多归纳总结,掌握反应类型之间的共性,降低学习难度。
5. 结语
化学方程式是化学学习的核心内容,掌握它们不仅能帮助你在考试中取得好成绩,还能提升对化学本质的理解。通过从简单反应入手、理解反应原理、练习配平以及运用视觉化工具,你可以更高效地学习化学方程式。希望本文的建议能够帮助你在化学学习中取得更大的进步!
常见化学方程式示例
- 水的分解:2H₂O → 2H₂ + O₂
- 铁生锈:4Fe + 3O₂ → 2Fe₂O₃
- 中和反应:NaOH + HCl → NaCl + H₂O
- 沉淀反应:BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl
通过不断练习和总结,你将能够熟练运用化学方程式,理解化学反应的本质,并在化学学习中取得优异的成绩!
声明:本站资源来自会员发布以及互联网公开收集,不代表本站立场,仅限学习交流使用,请遵循相关法律法规,请在下载后24小时内删除。 如有侵权争议、不妥之处请联系本站删除处理! 请用户仔细辨认内容的真实性,避免上当受骗!